Research.01
ハイドロゲル微粒子
ハイドロゲル微粒子とは
当研究室では、わずか数%の高分子と約90%の水から構成されるハイドロゲル微粒子の開発を行っています。これまでに開発してきたゲル微粒子は10nmから10μmまでの範囲で、サイズが厳密に揃っています。そして温度やpHといった外部環境の変化を認識し、微粒子の大きさや親疎水性といった特徴を瞬時に変える環境応答性を有しています。また、水で膨らんだ3次元の網目構造を持つため、薬剤やタンパク質、染料などの機能分子を微粒子内部に閉じ込めることが可能であり、その上環境を認識して必要なタイミングで微粒子の外へと放出することができるスマート材料です。
こうしたゲル微粒子は、とても小さいうえにほとんどが液体から構成されているため、これまでの研究ではどうしてそのような特徴を示すのか?どのようにしたら新しい機能を創りだし、それを緻密にコントロールできるのか?などの答えを出せる研究者は世界のどこにもいませんでした。
そのような背景の中で、当研究室はゲル微粒子の特徴の理解と制御を目指して、独自の微粒子合成技術と最先端の計測技術を活用し、未だかつてない新しいゲル微粒子を作り出す独創的な研究を行っています。
開発したゲル微粒子の一例
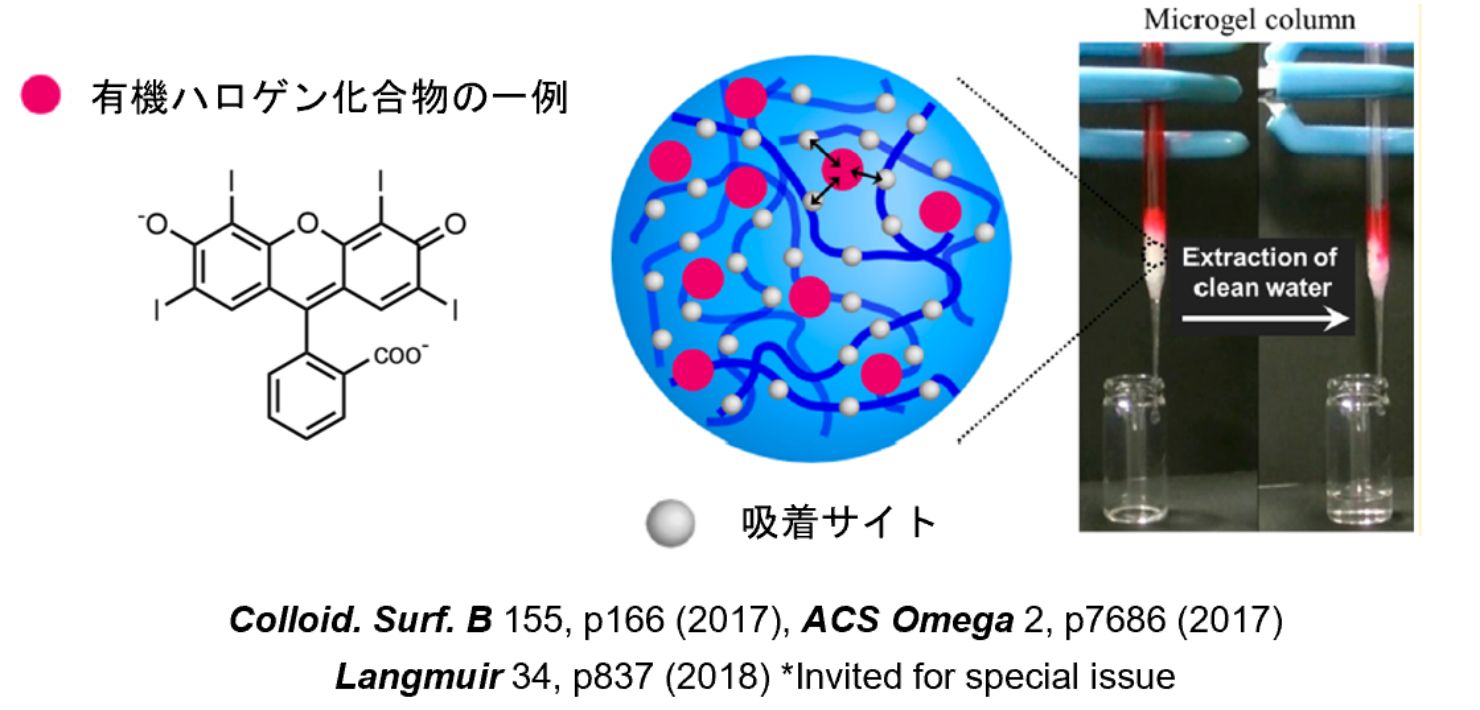
list.1 有機ハロゲン化合物を高選択的に分離できるゲル微粒子
薬剤や環境汚染物質、X線造影剤などに活用されている有機ハロゲン化合物を選択的にゲル微粒子内部に取り込むことに成功しました。図は、このゲル微粒子をカラムの充填剤として活用することで、モデルとして用いた有機ハロゲン化合物(Rose Bengal)を100%効率で分離を達成したものです(特許取得済み)。限りある資源の再利用や、新しいドラッグデリバリーシステム(DDS)、環境汚染の防止に役立てたいと考えています。
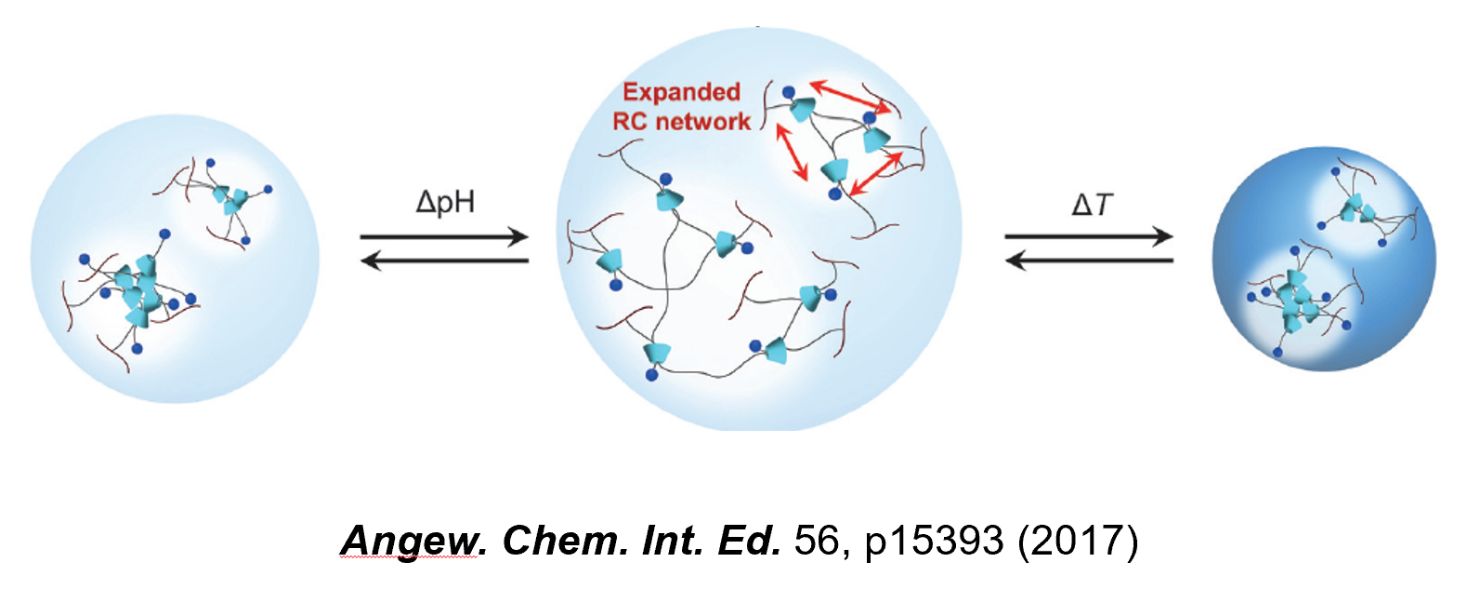
list.2 分子マシン”架橋ゲル微粒子
ゲル微粒子は、環境変化(例えば外部の温度やpHなど)に応じて、サイズを可逆的に変化させることなどができます。しかし、ある刺激に応答すると、もう一方の刺激には応答しなくなる、など刺激応答性を精密に制御することは困難でした。
そこで当研究室で注目したのは、分子マシンから成る架橋剤、ロタキサンです。(ちなみに分子マシン(molecular machine)は、2016年のノーベル化学賞の受賞対象です。)当研究室の独自の合成技術により、輪と軸が連結したロタキサンを架橋剤として用いたゲル微粒子は、温度に応答するゲル微粒子本体に対してpHに応答する架橋剤のリング状成分が自由に動けるため、温度とpHの変化に対して、互いに干渉しない刺激応答性が創出されました(東京工業大学 高田教授との共同研究成果)。例えば、部位ごとに環境が大きく異なる体内において、狙った場所に薬剤を輸送する機能の発現が期待できます。
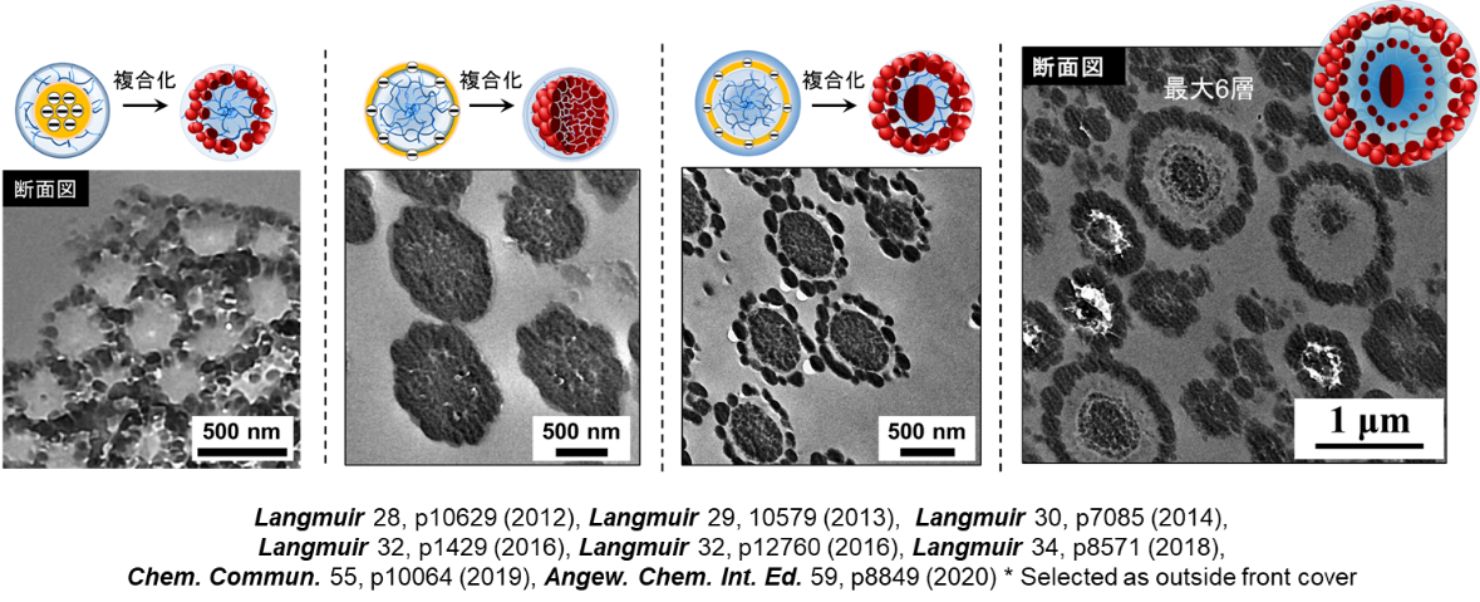
list.3 ナノコンポジットゲル微粒子
ハイドロゲル微粒子は水が大好きです。しかし応用展開を考えた時、水だけを愛してしまっては(油を嫌ってしまっては)、応用の範囲が極端に制限されてしまいます。当研究室では、ゲル微粒子をフラスコ内に残したまま、油が大好きなモノマーの重合を行うと、100%効率でゲル微粒子と複合化することを偶然見出しました。
この偶然の発見をきっかけに、ゲル微粒子の柔らかさや荷電基の分布などを制御した実験を徹底的に行いました。その結果、図に示すように、油が好きな疎水性成分を水が大好きなゲル微粒子の局所にナノメートルスケールの空間分解能で配置場所をコントロールする技術を開発することに成功しました(特許取得済み)。ゲル微粒子は食品や化粧品に使われてきました。当研究室がナノコンポジットゲル微粒子を用いることで、従来のゲル微粒子とは異なる性質や機能の付与が可能となり、水と油の界面を強く安定化させる乳化剤や、光通信材料、医療分野(薬物運搬担体など)への応用展開が新たに期待されます。
list.4 細胞のような巨大ゲル微粒子
私たち人間は37兆個の細胞から構成されています。その細胞は、日々新しいものと入れ替わるため、私たちの体は3か月の周期ですべて新しい細胞に置き換わると言われています。その細胞は、例えば赤血球の10㎛のように、これまで世界的に研究されてきたゲル微粒子よりも大きなサイズです。実は、小さなナノ粒子(大きさがナノメートル)を作るより、細胞と同じくらいのマイクロ粒子(大きさがマイクロメートル)をサイズを揃えて合成することは難しいのです。
当研究室では、ゲル微粒子を重合する際に低温から重合を開始し、重合開始直後に重合温度を昇温させることで細胞のような巨大ゲル微粒子を開発することに成功しました。例えば、水中では7μm、水と空気の界面では21μmまでのサイズを変化させることができます。ゲル微粒子は界面に吸着する瞬間のわずか0.1秒で大きく変形することを見出しました。私たちの体は細胞から構成されており、例えばそれら細胞の異変は病気につながります。まだまだ分かっていないことが多い細胞を理解するためのモデルとしての活用が期待されます(特許取得済み)。また、細胞はヒトそれぞれ異なります。万能細胞(iPS細胞やES細胞)の研究が盛んである昨今、私たちは、細胞そのものではないゲル微粒子を活用することで、細胞を超越する人工システムの構築を目指して研究を進めています。

list.5 その他のハイドロゲル微粒子
一般的な球状とは異なる棒状のゲル微粒子、半面ごとに異なる性質を持つヤヌス型ゲル微粒子、ゲル微粒子内部に化学反応を促進させる金属ナノ粒子を固定した触媒ゲル微粒子、など、数多くの機能性ゲル微粒子を開発しています。まだ公にできないゲル微粒子も多数あり、随時発表できるように研究を進めて参ります。
ハイドロゲル微粒子のナノ構造解析
当研究室では、様々な特徴をもつハイドルゲル微粒子の合成だけでなく、先端計測技術を用いたゲル微粒子の構造解析についても精力的に研究しています。多くは当研究室所有の装置でも実験することはできますが、最先端の装置を活用した実験は学外との共同研究によって進めています。
list.1 クライオ電子線トモグラフィー法
その一つ目は、クライオ電子線トモグラフィー法です。ゲル微粒子の構造解析に主に用いられる走査型電子顕微鏡(SEM)等の電子顕微鏡法は、真空(乾燥)条件下で観察を行うため試料を脱水する過程が不可欠です。SEMから分かることも多くあります。しかし、本来の姿である水で膨らんだ状態のゲル微粒子を評価することができません。Cryo-トモグラフィー電子顕微鏡法では、極低温下で凍結したゲル微粒子の連続切片画像を得られるため、膨らんだ状態のナノ構造を精密に評価することができます。特に、研究室の独自技術によって開発を進めるナノコンポジットゲル微粒子は、内部の空間を高い分解能で可視化できます。この手法によって、親水的なゲル微粒子内部に対して、疎水的な硬質成分が複合化する際の法則を解明することに成功しました(生理学研究所 村田教授らとの共同研究)。
Angew. Chem. Int. Ed. 132, p8934 (2020).
list.2 高速原子間力顕微鏡法(高速AFM)
二つ目は、高速原子間力顕微鏡法(高速AFM)です。高速AFMは、分子が動くさまを直接、ほぼリアルタイムに観察できる手法で、主にタンパク質等の生体分子の動態解析を目的とし、日本で開発が進められてきました。当研究室では環境に応じてリアルタイムに構造が変化するゲル微粒子の評価に最適であると確信し、微粒子一粒のナノ構造が環境に応答して変化する様子の可視化に成功しました。その結果、温度応答性ゲル微粒子の内部には無数の非温度応答性ナノ構造が存在することや、ドラッグデリバリーシステム(DDS)に応用するうえで不可欠なゲル微粒子内部へのタンパク質の吸脱着挙動の詳細を明らかにすることに成功しました(名古屋大学 内橋教授との共同研究)。動画は、温度応答性ゲル微粒子が実際に温度変化に伴って収縮する様子をリアルタイムで観察した動画です(左:形状像、右:3D像)
Angew. Chem. Int. Ed. 58, p8809 (2019).
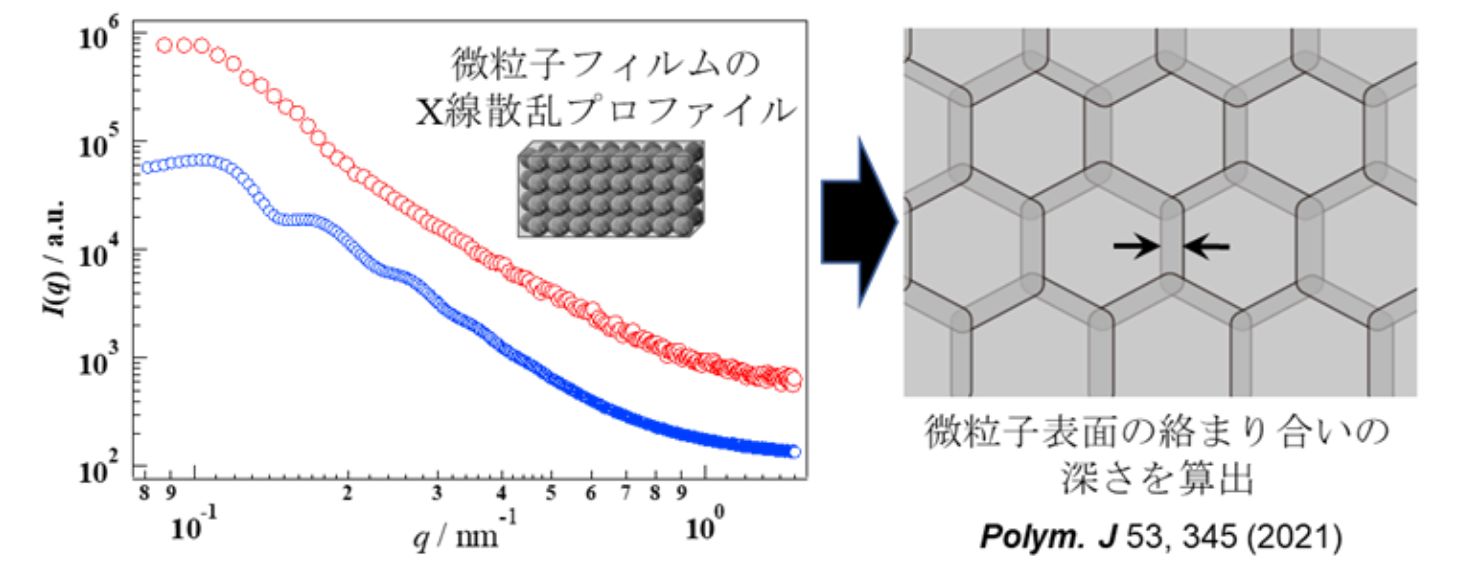
list.2 放射光散乱実験
三つ目は、放射光散乱実験です。Spring-8等が所有する大型装置を活用することで、当研究室が所有する光散乱装置では明らかにできない微粒子のナノ構造評価が可能となります。上で述べた顕微鏡法では、せいぜい十数個の微粒子の評価が限界です。顕微鏡法に散乱実験の結果を補うことで、天文学的な数の微粒子からなる材料や分散液の詳細な情報を正確につかむことが可能となりました(弘前大学 呉羽助教との共同研究)。
このように当研究室では、新しいハイドロゲル微粒子の開発と構造明確化を通じて、微粒子の機能が発現するメカニズムの解明や、機能を最大限発揮するゲル微粒子の設計指針の確立を目指しています。
